Primeira imagem de uma proteína individual
Redação do Diário da Saúde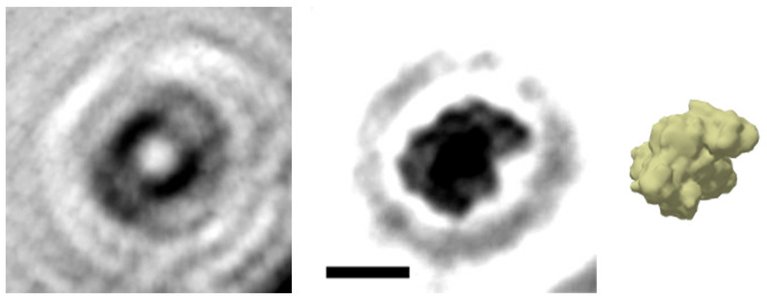
[Imagem: Jean-Nicolas Longchamp/University of Zurich]
Foto de uma proteína
Embora falem o tempo todo nas proteínas e em seus dobramentos, esta é a primeira imagem razoavelmente clara que os cientistas já obtiveram de uma molécula de proteína dobrada.
As proteínas são as ferramentas da vida, mas as coisas podem começar a dar errado quando seus dobramentos não saem como esperado.
Conhecer a estrutura de cada proteína é de interesse não só para os biólogos que querem entender como funciona um organismo, mas também para os médicos e farmacêuticos, que precisam saber como as proteínas são construídas, como elas interagem com outras proteínas e com moléculas menores, e como esses pontos de ligação mudam conforme a proteína desempenha suas funções.
Com a possibilidade de vê-las diretamente, passa a ser possível examinar moléculas individuais para saber tudo isto e mais - por exemplo, como elas interagem com potenciais medicamentos, para tentar corrigir seu comportamento quando as coisas começam a dar errado.

[Imagem: Tatiana Latychevskaia /University of Zurich]
Holograma eletrônico
A primeira imagem da proteína dobrada foi possível graças a uma técnica de holograma eletrônico desenvolvida por uma equipe da Universidade de Zurique (Suíça) e do Instituto Max Planck (Alemanha). Embora a geração de hologramas seja bem conhecida, foi necessário desenvolver uma técnica com elétrons de energia muito baixa, para não danificar a proteína que está sendo observada.
Os métodos atuais, tais como análise por raios X e a microscopia crioeletrônica, exigem que as biomoléculas estejam cristalizadas ou que se use uma grande quantidade de cada proteína.
O problema é que muitas proteínas não crescem na forma de cristais e, quando se usam valores médios nem sempre é possível detectar diferenças entre várias conformações, isto é, variantes estruturais da biomolécula. E são precisamente essas variações que são importantes na busca de novos fármacos, uma vez que as proteínas assumem várias conformações quando desempenham suas funções.
| Ver mais notícias sobre os temas: | |||
Nanotecnologia | Desenvolvimento de Medicamentos | Alimentação e Nutrição | |
| Ver todos os temas >> | |||
Descobertos efeitos magnéticos na origem da vida
Do autismo ao Alzheimer, a culpa pode estar no metabolismo do cérebro
Precisamos conhecer as mudanças cerebrais na meia-idade
Spray nasal dá resultados promissores contra apneia do sono
Não é a escola que é boa, os alunos bons é que se matriculam lá
Conheça o seu ageótipo, que determina como será seu envelhecimento
Casca da jabuticaba combate síndrome metabólica e obesidade
Entra em vigor autorização eletrônica para doação de órgãos
Usar cannabis recreativamente protege contra declínio cognitivo, diz pesquisa
Mapas corporais mostram onde você sente a música
Cultivar a espiritualidade reduz a pressão arterial
Interface cérebro-computador universal obedece comandos de qualquer pessoa
Capacidade funcional na velhice é como um ecossistema que pode entrar em colapso
Bactérias do queijo de cabra têm forte potencial probiótico
Micromaterial libera nanopartículas que destroem só as células do câncer
Luz UVC distante elimina vírus sem fazer mal aos seres humanos
Bateria que recarrega com oxigênio do corpo também pode destruir tumores
Produtos químicos domésticos comuns ameaçam saúde do cérebro
Mapeadas bactérias que ajudam o câncer ou atrapalham os tratamentos
Cuidado com os excessos no uso de suplementos de vitamina D
Censo 2022: Por que várias cidades brasileiras tiveram diminuição da população?
Brasil tem primeiro caso de gripe aviária em aves domésticas
Brasil decreta emergência zoossanitária devido à gripe aviária
Proibido o uso de animais em pesquisas de cosméticos e higiene pessoal
Anvisa aprova medicamento para tratamento de internados com covid-19
ANS lança campanha contra cesarianas desnecessárias
A informação disponível neste site é estritamente jornalística, não substituindo o parecer médico profissional. Sempre consulte o seu médico sobre qualquer assunto relativo à sua saúde e aos seus tratamentos e medicamentos.
Copyright 2006-2024 www.diariodasaude.com.br. Todos os direitos reservados para os respectivos detentores das marcas. Reprodução proibida.


