Processo limpo purifica proteínas para fármacos e biossensores
Com informações da Agência Fapesp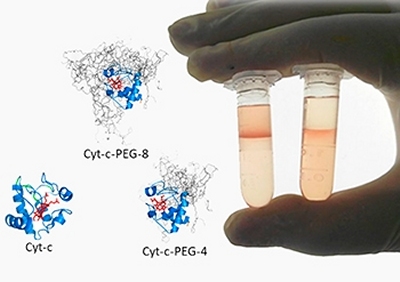
[Imagem: João H. P. M. Santos et al./Fapesp]
Peguilação química
Um método inovador e sustentável para a purificação de uma classe de medicamento biológico, as proteínas peguiladas, promete avanços não apenas para a indústria farmacêutica, mas também para a de alimentos e até a agroindústria.
A nova técnica foi desenvolvida por pesquisadores da USP (Universidade de São Paulo) e da Universidade de Aveiro, em Portugal.
A purificação e modificação das proteínas consiste na peguilação química, ou seja, a ligação covalente de polietilenoglicol à proteína. "Este processo corresponde a cerca de 80% do custo total do fármaco," disse a professora Carlota Rangel Yagui.
A peguilação é uma das principais técnicas empregadas atualmente para obtenção de biofármacos - e suas versões melhoradas, os "biomelhorados". Entre os exemplos de proteínas peguiladas estão biofármacos aplicados para o tratamento de doenças como imunodeficiência combinada grave ou leucemia linfoide aguda.
Com o novo processo, toda a purificação das proteínas é feita usando água como solvente, o que traz uma elevada compatibilidade com as proteínas, baixo custo e fácil escalonamento do processo - hoje as proteínas são purificadas pelo método de cromatografia, que é caro e apresenta grande volume de perda das proteínas.
"Conseguimos realizar a purificação das moléculas em três etapas, em um processo mais sustentável e econômico do que o cromatográfico. Os sistemas aquosos bifásicos, compostos somente por água e outras duas substâncias, como um polímero ou um sal, já são usados na purificação de outras substâncias e se mostraram altamente eficientes para as proteínas peguiladas," disse Carlota.
Biossensores
A equipe propõe também que a peguilação de uma proteína seja utilizada como biossensor.
Para isso, a equipe trabalhou com moléculas de citocromo c, uma proteína capaz de catalisar processos oxidativos e que pode ser empregada como dispositivo analítico que detecta alterações em amostras.
"Biossensores são moléculas de interesse industrial, não só para a indústria farmacêutica, mas também para a de alimentos e a agroindústria. [...] propusemos o citocromo c como um biossensor e agora queremos estudar se ele consegue ter uma vida útil maior com a peguilação," disse Carlota.
Biossensores enzimáticos costumam ter duração limitada devido à desnaturação por variação de temperatura e pH e exposição ao material dos eletrodos usados nos processos.
| Ver mais notícias sobre os temas: | |||
Biotecnologia | Sensores | Desenvolvimento de Medicamentos | |
| Ver todos os temas >> | |||
Privatização aumenta mortalidade e piora atendimento em hospitais
Cuidado com o tipo de vitamina D que você está tomando
Vacinas que domam sistema imunológico poderão proteger até contra câncer
Risco de demência aumenta com qualquer consumo de álcool, diz megaestudo
Vacinação contra covid é crucial para proteger o coração
Sinais de WiFi da sua casa vão monitorar seus batimentos cardíacos
Treino de força rejuvenesce nervos e previne quedas em idosos
Sinais de alerta antecedem quase todos os ataques cardíacos e AVCs
Luz artificial altera sincronização do corpo feminino com a Lua
Seus pensamentos poderão ser lidos nas suas expressões faciais - mesmo em vídeos
Esqueça as fibras: Contra intestino preso, vá de kiwi
Cientistas dizem que o glúten pode não ser o problema, afinal
Implante de retina restaura visão em pacientes com degeneração macular
Gesticular enquanto fala ajuda crianças com transtornos de linguagem
Descoberto antibiótico que não gera resistência nas bactérias
Fragilidade física pode ser causa, e não sintoma da demência
Por que é tão difícil acabar com o ódio político?
Rica em açúcar, manga pode proteger contra diabetes
Colírio inovador atinge a retina para prevenir problemas graves de visão
Hologramas de ultrassom vão tratar Alzheimer, Parkinson e muito mais
Vacina do Butantan contra dengue grave tem 89% de proteção
Brasil tem primeiras mortes por febre oropouche no mundo
Censo 2022: Por que várias cidades brasileiras tiveram diminuição da população?
Brasil tem primeiro caso de gripe aviária em aves domésticas
Brasil decreta emergência zoossanitária devido à gripe aviária
Proibido o uso de animais em pesquisas de cosméticos e higiene pessoal
A informação disponível neste site é estritamente jornalística, não substituindo o parecer médico profissional. Sempre consulte o seu médico sobre qualquer assunto relativo à sua saúde e aos seus tratamentos e medicamentos.
Copyright 2006-2025 www.diariodasaude.com.br. Todos os direitos reservados para os respectivos detentores das marcas. Reprodução proibida.


