Desvendados estágios iniciais da doença de Parkinson
Redação do Diário da Saúde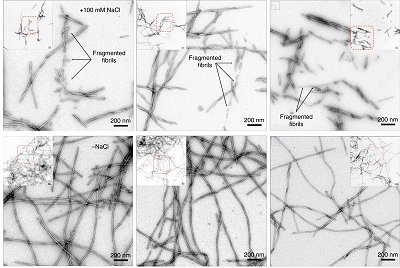
[Imagem: Guilherme Oliveira/Jerson Silva]
Como começa o Parkinson
Usando técnicas de ponta em microscopia eletrônica, cientistas do Brasil e dos EUA identificaram estruturas proteicas que podem explicar o início precoce da doença de Parkinson.
Uma das maiores dificuldades no tratamento contra a doença neurodegenerativa progressiva é a falta de entendimento sobre o momento exato em que a enfermidade começa a se desenvolver.
Agora, pesquisadores da UFRJ (Universidade Federal do Rio de Janeiro) e da Universidade da Virgínia (EUA) observaram, pela primeira vez, como diferentes variantes da alfa-sinucleína, proteína associada à enfermidade, interagem ao longo do tempo.
A partir disso, eles conseguiram identificar a formação inicial de agregados da proteína ligados aos casos precoces do Parkinson.
Compreender como essas estruturas se organizam é fundamental para identificar os estágios iniciais da doença. Já se sabe que a degeneração dos neurônios que leva ao aparecimento dos sintomas, como tremores e lentidão dos movimentos, está ligada ao acúmulo de agregados da alfa-sinucleína no cérebro, os chamados filamentos amiloides.
Antes de formarem tais filamentos, as proteínas passam por um estágio intermediário, os oligômeros, que também estão presentes nos cérebros dos pacientes com Parkinson. Apesar de conhecerem essas estruturas, os cientistas ainda não compreendem como seu surgimento se dá, nem seus graus de toxicidade para os neurônios.
"Uma pessoa desenvolve Parkinson ao longo de toda a vida. A conversão entre os estágios da proteína acontece lentamente e as estruturas intermediárias e os filamentos se acumulam por muito tempo. E não sabemos qual dos dois desencadeia o surgimento dos sintomas e é mais tóxico para as células," explicou o pesquisador Guilherme de Oliveira. "Se conseguirmos entender o início da conversão, poderemos desenvolver uma terapia para o tratamento precoce da doença."
Alfa-sinucleína
Os cientistas compararam a dinâmica de formação dessas neuroestruturas em quatro variantes da alfa-sinucleína, sendo três delas ligadas a casos hereditários precoces da doença de Parkinson e uma presente nos casos de envelhecimento. A partir daí, eles observaram diferenças significativas nos processos de agregação de cada variante da proteína e descobriram que, nos casos de Parkinson precoce, os estágios intermediários se formam em uma velocidade muito maior do que nos casos de envelhecimento. Isso pode explicar o surgimento dos sintomas em pessoas mais jovens.
Os pesquisadores também encontraram evidências de quais tipos de proteína são importantes para o surgimento dos filamentos amiloides e, mais do que isso, que os filamentos apresentam estruturas distintas, dependendo da variante da proteína da qual se originam.
"O interessante é que não só os estágios iniciais da conversão são diferentes, mas que alguns filamentos que se formam em casos de Parkinson precoce também são. Dependendo da mutação presente, esses filamentos se torcem de formas diferentes," explicou Jerson Lima Silva, membro da equipe.
Artigo: Alpha-synuclein stepwise aggregation reveals features of an early onset mutation in Parkinson’s disease
Autores: Guilherme A. P. de Oliveira, Jerson L. Silva
Publicação: Communications Biology
Vol.: 2, Article number: 374
DOI: 10.1038/s42003-019-0598-9
| Ver mais notícias sobre os temas: | |||
Neurociências | Cérebro | Memória | |
| Ver todos os temas >> | |||
Brasileiros estão vivendo mais de 110 anos e os cientistas querem saber o porquê
Solução doce para a calvície? Stévia estimula crescimento capilar
Há vários caminhos para melhorar a saúde mental
Dormir menos de 7 horas pode reduzir anos da sua vida
Jovens talentosos estão sendo orientados da maneira errada
Descoberta forma de fortalecer resposta imunológica contra o câncer
Tagatose: Novo açúcar adoça sem as desvantagens habituais
Quarto mais frio ajuda recuperação do coração durante o sono
Bambu pode se tornar superalimento mundial
Novo material que destrói o câncer tem participação de cientista brasileira
Nossa memória não funciona do modo como os cientistas pensavam
Ossos podem ter benefícios do exercício sem que seja necessário se movimentar
Casca de romã combate infecções na pele
Infarto não é evento isolado, envolvendo cérebro, coração e sistema imune
Curativo com antioxidante destrói bactérias melhor que antibiótico
Sensores sem bateria monitoram sua saúde sem lhe incomodar
Novo material que destrói o câncer tem participação de cientista brasileira
Combinação de químicos seguros gera mistura tóxica por gerações
Exposição à luz natural melhora saúde metabólica e diabetes
Argumentos sobre cuidado e justiça convencem progressistas e conservadores
Vacina do Butantan contra dengue grave tem 89% de proteção
Brasil tem primeiras mortes por febre oropouche no mundo
Censo 2022: Por que várias cidades brasileiras tiveram diminuição da população?
Brasil tem primeiro caso de gripe aviária em aves domésticas
Brasil decreta emergência zoossanitária devido à gripe aviária
Proibido o uso de animais em pesquisas de cosméticos e higiene pessoal
A informação disponível neste site é estritamente jornalística, não substituindo o parecer médico profissional. Sempre consulte o seu médico sobre qualquer assunto relativo à sua saúde e aos seus tratamentos e medicamentos.
Copyright 2006-2026 www.diariodasaude.com.br. Todos os direitos reservados para os respectivos detentores das marcas. Reprodução proibida.


